Již v roce 1946 ukázali von Euler a Liljestrand [1], že hyperkapnie vyvolává akutní plicní hypertenzi. Nisell [2] na izolovaných plicích prokázal, že jde podobně jako při HPV o mechanismus nezávislý na nervovém systému. Jeho síla je však ve fyziologickém rozmezí několikrát menší než síla HPV [3] a u dospělých lidí se v podstatě neuplatňuje [4]. Významnější je, že hyperkapnie potencuje a hypokapnie oslabuje HPV [3, 4, 5, 6, 7, 8]. Jak k tomu dochází, není zcela jasné. Je možné, že jde o působení zprostředkované změnami pH [3, 5, 9]. Přímý účinek molekuly CO2 je možná spíše vazorelaxační [10].
Extracelulární acidóza potencuje HPV (zejména odpověď na mírnější hypoxii), alkalóza ji oslabuje [11, 12, 13, 14, 15, 16, 17, 18]. Bylo pozorováno i oslabení HPV při jakékoliv odchylce od normálního pH [19, 20]. Mechanismus není znám. Uplatňuje se ovlivnění bazálního tonu, protože i v normoxii vyvolá acidóza plicní vazokonstrikci [14, 15, 21, 22, 16, 23] a alkalóza vazodilataci [17, 18]. K potenciaci HPV acidózou však dochází i tehdy, není-li výchozí hodnota plicního cévního odporu (při normoxii) poklesem pH zvýšena [13].
Raffestinová a McMurtry [24] zjistili, že změny intracelulárního pH mají na HPV opačný účinek než změny extracelulární: pokles oslabuje HPV a vzestup ji potencuje. To je v souladu s nálezem, že alkalizace sarkoplazmy cévního hladkého svalu uvolňuje Ca2+ z intracelulárních zásob a zvyšuje [Ca2+]i [25]. Je tedy pravděpodobné, že pH krve se uplatňuje spíše prostřednictvím působení na složky buněčné membrány než ovlivněním intracelulárního pH, které si buňka sama přesně reguluje [26].
Změny intracelulárního pH mohou ostatně být součástí mechanismu HPV. Akutní hypoxie působí intracelulární acidifikaci buněk hladkého svalu plicních cév (Madden). Pokles intracelulárního pH uzavírá napětím řízené draslíkové kanály v plasmatické membráně hladkého svalu plícnice [89]. Tento účinek je zřejmě specifický pro plicní cévy: v hladkém svalu koronárních tepen naopak intracelulární acidifikace napětím řízené draslíkové kanály otevírá [89]. Snížení aktivity napětím řízených draslíkových kanálů je známým článkem mechanismu HPV. Vede totiž k depolarizaci a tím k vazokonstrikci.
Reaktivita plicních cév závisí na stavu vazomotorického tonu v plicích [27]. Bylo to prokázáno u řady látek (acetylcholin, noradrenalin, adrenalin, histamin, substance P) pro velikost nebo polaritu (vazokonstrikce vs. vazodilatace) odpovědi [28, 29, 30, 31].
Pokusy s izolovanými plícemi perfundovanými umělými perfuzáty ukázaly, že také reaktivita na akutní hypoxické podněty závisí na bazálním tonu. V takovém uspořádání totiž prakticky nelze HPV vyvolat [32]. Objevuje se však po přidání subpresorických dávek angiotesinu II, KCl, vanadátu, noradrenalinu, 4-aminopyridinu, dexametazonu, či tromboxanového analogu (U46619) do perfuzátu [33, 34, 35, 36]. Společné všem těmto látkám je to, že různými způsoby zvyšují bazální tonus plicních cév.
K faktorům regulujícím bazální tonus patří také většina látek zkoumaných z hlediska mechanismu HPV (histamin, eikosanoidový systém, souhra alfa a beta adrenergních receptorů, serotonin, angiotensin II, ET-1, NO, atriový natriuretický peptid, cyklické nukleotidy). Inhibitory účinku a syntézy těchto látek mají rovněž často nespecifický účinek na bazální tonus, což znesnadňuje výzkum jejich úlohy v HPV. Také ovlivnění HPV nervovými vlivy [37, 38] je pravděpodobně důsledkem změn bazálního tonu.
U pokusných zvířat [39, 40, 41, 42, 43], u zdravých lidí [44, 45] i u pacientů s chronickou plicní obstrukcí [46] byla pozorována značná individuální variabilita v síle HPV. Silou HPV se liší různé kmeny [47] i různé chovy téhož kmene [48, 49] laboratorního potkana.
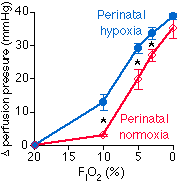
Není jasné, co je příčinou těchto rozdílů. Často jde o rozdílnou schopnost tlumit HPV vazodilatačními prostaglandiny. Mnohé rozdíly totiž vyrovná farmakologická inhibice cyklooxygenázy [40, 41, 43]. Uplatňují se i rozdíly v bazálním tonu. Ve studii Hymana a Kadowitze [30] mělo 12% koček spontánně zvýšený klidový tonus plicního cévního hladkého svalu. Je možné, že určitou roli má i individuální variabilita faktorů, které bazální tonus a HPV ovlivňují, např. hospodaření s Ca2+, funkce endotelu či histiocytů a modulující působení nervového systému, atriového natriuretického peptidu či eikosanoidů. Růst HPV během opakování hypoxického podnětu naznačuje, že pro velikost HPV může být důležitá dosavadní historie probanda. Z tohoto hlediska zaujímá zvlástě významnou pozici perinatální období [50] (Obr. 8-1).

Reaktivita na hypoxii je větší u samců než u samic [51, 52]. Tento rozdíl vzniká v pubertě, kdy HPV samic slábne, zatímco u samců se nemění [51]. Rozdíl dále přechodně prohlubuje gravidita [53, 54, 55, 52]. Tyto nálezy naznačují a další poznatky potvrzují, že HPV je pravděpodobně tlumena samičími pohlavními hormóny. Izolované plíce březích samic laboratorního potkana mají podobnou reaktivitu jako plíce kontrolní, pokud jsou oba preparáty perfundovány krví kontrolních samic. Při perfúzi krví březích samic dochází u obou skupin k podobnému poklesu HPV [55]. HPV kontrolních fen se přiblíží reaktivitě fen březích po 2 týdnech podávání estrogenu, zatímco progesteron je bez účinku [54]. V podobném pokuse se samicemi potkana byl naopak neúčinný estradiol [55]. Podávání estardiolu po dobu 2-5 dní sníží HPV prepubertálních ovcí i postpubertálních kastrovaných beranů na úroveň nacházenou u dospělých ovcí [51].
Není známo, jakým mechanismem samičí pohlavní hormóny HPV otupují. Estrogeny mohou omezovat kontraktilitu cévního hladkého svalu [56], posilovat vazodilatační působení endotelu [57] a povzbuzovat tvorbu prostacyklinu [58]. Poslední mechanismus se však asi v případě HPV neuplatňuje, protože efekt gravidity na HPV není ovlivněn meklofenamátem [54].
Velikost HPV se v ontogenezi mění. U fétu se slabá HPV objevuje počátkem poslední třetiny gestace a do narození její velikost rychle stoupá [59, 60]. K dalšímu zesilování dochází i bezprostředně po narození. Donošená kůzlata mají silnější odpověď než mírně nedonošená [61].
O rozvoji HPV v neonatálním období jsou protichůdné údaje, způsobené asi mezidruhovými rozdíly. U králíků [62, 63] a potkanů [64] HPV dále roste během prvních postnatálních týdnů a u selat [65] a potkanů [64] i během několika prvních měsíců. Naopak u jehňat [66, 67] a telat [68, 69] byl změřen pokles síly HPV krátce po narození. Dospělé fretky mají podobně silnou HPV jako 3-5 týdnů stará mládata [70]. Na těchto mezidruhových rozdílech se může podílet rozdílné tlumení HPV vazodilatačními prostaglandiny [66, 67] a NO [71, 72, 73, 74].
Funkční změny souvisí s morfologickým vývojem. Rychle po narození ubývá v médii muskularizovaných plicních arteriol svaloviny, ale současně se diferencuje nový hladký sval v distálnějších arteriolách, které ho před narozením neměly [75]. Nová struktura cév se rychle fixuje ukládáním kolagenu v cévní stěně [76]. Cévní hladký sval začíná dozrávat [76].
Po dosažení dospělosti pozvolna klesá cévní reaktivita v celém organismu [77]. Projeví se to i slábnutím HPV [78, 79, 80]. Je pravděpodobné, že otupení HPV se podílí na zhoršení spřažení perfúze s ventilací ve stáří [81].
V perinatálním období dochází nejen k nejdramatictějším změnám síly HPV, ale i ke změnám v její lokalizaci. Plíce plodu naplněné tekutinou neplní respirační funkci. Proto zvýšení kapilárního tlaku a filtrace v nich není takovým rizikem jako v extrauterinním životě. Mohou si tedy dovolit silnou hypoxickou venokonstrikci, která by navíc mohla významně pomáhat udržovat potřebně vysoký plicní cévní odpor. U novorozených (na rozdíl od dospělých) pokusných zvířat bylo skutečne zjištěno, že konstrikce plicních žil je v odpovědi na hypoxii rovnocenná stahu arteriol. Bressack a Blend [82] srovnávali plicní kapilární filtraci dospělých ovcí a novorozených jehňat. U ovcí se při hypoxii nezměnila, u jehňat výrazně stoupla. Tlak v zaklíněném katetru se při HPV u dospělých ovcí nemění, u novorozených roste [83]. Přímé měření tlaku v plicních arteriolách a venulách o průměru 20-80 um ukázalo při hypoxii přibližně stejný růst odporu v malých vénách a artériích u novorozených jehňat, ne však dospělých ovcí [84, 85]. V podobné studii s novorozenými králíky byl však podíl arteriol o průměru nad 60 um na HPV větší než podíl žil [86]. Při katetrizačním vyšetření starších jehňat (1-3 měsíce) vedla akutní hypoxie ke zvýšení tlaku v malé lobární artérii, ale již ne v malé žíle [87]. Hypoxická venokonstrikce má tedy zřejmě důležitou roli v plicích plodu. V ranném postnatálním období její význam klesá a v dospělosti se téměř neuplatňuje.
Předpokládá se, že mechanismus HPV je u všech druhů v podstatě stejný. Důvodem je jednak fylogenetické stáří HPV a dále skutečnost, že charakter závislosti vazokonstrikce na stupni hypoxie je u všech studovaných druhů podobný. Má sigmoidní průběh s inflexemi při přibližně stejných hodnotách PO2. Při změnách PO2 v supranormální oblasti jsou změny cévního tonu vždy minimální. Rozdíly v síle HPV tedy asi souvisí s rozdíly v její modulaci výše diskutovanými faktory.
Mezi druhy se silnou HPV patří skot a prase. Poměrně slabá HPV je u psů, ovcí a králíků. Človek a potkan patří do středu škály [88].
| Předchozí část... |
|
1. von Euler US, Liljestrand G: Observations on the pulmonary arterial blood pressure in the cat. Acta Physiol Scand 1946; 12: 301-320.
2. Nisell O: Effects of oxygen and carbon dioxide on the circulation of isolated and perfused lungs of the cat. Acta Physiol Scand 1949; 16: 121-127.
3. Barer GR, Howard P, Shaw JW: Stimulus-response curves for the pulmonary vascular bed to hypoxia and hypercapnia. J Physiol 1970; 211: 139-155.
4. Durand J, Ladurie ML, Ranson-Bitker B: Effects of hypoxia and hypercapnia on the repartition of pulmonary blood flow in supine subjects. In: Widimsky J, Daum S, Herzog H, Eds. Pulmonary Circulation. Basel, Karger, 1970; 156-165. (Herzog H, ed. Progress in Respiration Research; vol 5).
5. Barer GR, Shaw JW: Pulmonary vasodilator and vasoconstrictor actions of carbon dioxide. J Physiol 1971; 213: 633-645.
6. Benumof JL, Mathers JM, Wahrenbrock EA: Cyclic hypoxic pulmonary vasoconstriction induced by concomitant carbon dioxide changes. J Appl Physiol 1976; 41: 466-469.
7. Noble WH, Kay JC, Fisher JA: The effect of PCO2 on hypoxic pulmonary vasoconstriction. Can Anaesth Soc J 1981; 28: 421-430.
8. Orchard CH, Leon de RS, Sykes MK: The relationship between hypoxic pulmonary vasoconstriction and arterial oxygen tension in the intact dog. J Physiol 1983; 338: 61-74.
9. Emery CJ, Sloan PJM, Mohammed FH, Barer GR: The action of hypercapnia on pulmonary vessels. Bull Eur Physiopathol Respir 1977; 13: 763-776.
10. Viles PH, Shepherd JT: Evidence for a dilator action of carbon dioxide on the pulmonary vessels of the cat. Circ Res 1968; 22: 325-332.
11. Lloyd T: Effect of alveolar hypoxia on pulmonary vascular resistance. J Appl Physiol 1964; 19: 1086-1094.
12. Vogel JHK, Blount SG: The role of hydrogen ion concentration in the regulation of pulmonary arterial pressure. Circulation 1965; 32: 788-796.
13. Lloyd TC: Influence of blood pH on hypoxic pulmonary vasoconstriction. J Appl Physiol 1966; 21: 358-364.
14. Rudolph AM, Yuan S: Response of the pulmonary vasculature to hypoxia and H+ ion concentration changes. J Clin Invest 1966; 45: 399-411.
15. Silove ED, Inoue T, Grover RF: Comparison of hypoxia, pH, and sympathomimetic drugs on bovine pulmonary vasculature. J Appl Physiol 1968; 24: 355-365.
16. Thilenius OG, Derenzo C: Effects of acutely induced changes in arterial pH on pulmonary vascular resistance during normoxia and hypoxia in awake dogs. Clin Sci 1972; 42: 277-287.
17. Fike CD, Hansen TN: The effect of alkalosis on hypoxia-induced pulmonary vasoconstriction in lungs of newborn rabbits. Pediatr Res 1989; 25: 383-388.
18. Brimioulle S, Lejeune P, Vachiery J-L, Leeman M, Mélot C, Naeije R: Effects of acidosis and alkalosis on hypoxic pulmonary vasoconstriction in dogs. Am J Physiol 1990; 258: H347-H353.
19. Malik AB, Kidd BSL: Independent effects of changes in H+ and CO2 concentrations on hypoxic pulmonary vasoconstriction. J Appl Physiol 1973; 34: 318-323.
20. Marshall C, Lindgren L, Marshall BE: Metabolic and respiratory hydrogen ion effects on hypoxic pulmonary vasoconstriction. J Appl Physiol 1984; 57: 545-550.
21. Barer GR, McCurrie JR, Shaw JW: Effect of changes in blood pH on the vascular resistance of the normal and hypoxic cat lung. Cardiovasc Res 1971; 5: 490-497.
22. Herles F, Kolár J, Kozená J: Regional reactivity of the lung vessels to minute changes of acidity of perfusing fluid. Cardiovasc Res 1972; 6: 641-647.
23. Sada K, Shirai M, Ninomiya I: Changes in internal diameter, flow velocity and volume flow in small pulmonary vessels to metabolic acidosis. International symposium "Pulmonary Circulation V" 1989
24. Raffestin B, McMurtry IF: Effects of intracellular pH on hypoxic vasoconstriction in rat lungs. J Appl Physiol 1987; 63: 2524-2531.
25. Siskind MS, McCoy CE, Chobanian A, Schwartz JH: Regulation of intracellular calcium by cell pH in vascular smooth muscle cells. Am J Physiol 1989; 256: C234-C240.
26. Madshus IH: Regulation of intracellular pH in eukaryotic cells. Biochem J 1988; 250: 1-8.
27. Rudolph AM, Kurland MD, Auld PAM, Paul MH: Effects of vasodilator drugs on normal and serotonin-constricted pulmonary vessels of the dog. Am J Physiol 1959; 197: 617-623.
28. Barer GR, Emery CJ, Mohammed FH, Mungall IPF, Thompson B: H1 and H2 histamine receptors in the pulmonary circulation. J. Physiol. 1976; 259: 41.
29. Hyman AL, Kadowitz PJ: Enhancement of alpha- and beta-adrenoceptor responses by elevations in vascular tone in pulmonary circulation. Am J Physiol 1986; 250: H1109-H1116.
30. Hyman AL, Kadowitz PJ: Tone-dependent responses to acetylcholine in the feline pulmonary vascular bed. J Appl Physiol 1988; 64: 2002-2009.
31. Selig WM, Burhop KE, Garcia JGN, Malik AB: Substance P-induced pulmonary vasoreactivity in isolated perfused guinea pig lung. Circ Res 1988; 62: 196-203.
32. Gorsky BH, Lloyd TC: Effects of perfusate composition on hypoxic vasoconstriction in isolated lung lobes. J Appl Physiol 1967; 23: 683-686.
33. Berkov S: Hypoxic pulmonary vasoconstriction in the rat: the necessary role of angiotensin II. Circ Res 1974; 35: 257-261.
34. McMurtry IF: Angiotensin is not required for hypoxic constriction in salt solution-perfused rat lungs. J Appl Physiol 1984; 56: 375-380.
35. Herget J, McMurtry IF: Dexamethasone potentiates hypoxic vasoconstriction in salt solution-perfused rat lungs. Am J Physiol 1987; 253: H574-H581.
36. Marshall C, Marshall BE: Endothelium-derived relaxing factor is not responsible for inhibition of hypoxic pulmonary vasoconstriction by inhalational anesthetics. Anesthesiology 1990; 73: 441-448.
37. Ohmura A, Pace NL, Wong KC, Johansen RK: Hypoxic pulmonary vasoconstriction and the pharmacologically denervated lung. Roles of cardiac ouitput and sympathetic nervous system. Anaesthesia 1982; 37: 152-160.
38. Wilson LB, Levitzky MG: Chemoreflex blunting of hypoxic pulmonary vasoconstriction is vagally mediated. J Appl Physiol 1989; 66: 782-791.
39. Howard P, Barer GR, Thompson B, Warren PM, Abbott CJ, Mungall IPF: Factors causing and reversing vasoconstriction in unventilated lung. Respir Physiol 1975; 24: 325-345.
40. Hales CA, Rouse ET, Slate JL: Influence of aspirin and indomethacin on variability of alveolar hypoxic vasoconstriction. J Appl Physiol 1978; 45: 33-39.
41. Ahmed T, Oliver W, Wanner A: Variability of hypoxic pulmonary vasoconstriction in sheep: role of prostaglandins. Am Rev Respir Dis 1983; 127: 59-62.
42. Hakim TS, Malik AB: Hypoxic vasoconstriction in blood and plasma perfused lungs. Respir Physiol 1988; 72: 109-122.
43. Lejeune P, Deloof T, Leeman M, Mélot C, Naeije R: Multipoint pulmonary vascular pressure/flow relationships in hypoxic and in normoxic dogs: effects of nitrous oxide with and without cyclooxygenase inhibition. Anesthesiology 1988; 68: 92-99.
44. Reeves JT, Groves BM: Approach to the patient with pulmonary hypertension. In: Weir EK, Reeves JT, Eds. Pulmonary Hypertension. Mount Kisco, Futura, 1984; 1-44.
45. Richards AM, Ikram H, Nicholls MG, Espiner EA, Hamilton EJ, Richards RD: Ambulatory pulmonary arterial pressures in humans: relationship to arterial pressure and hormones. Am J Physiol 1986; 251: H101-H108.
46. Weitzenblum E, Schrijen F, Mohan-Kumar T, Colas des Francs V, Lockhart A: Variability of the pulmonary vascular response to acute hypoxia in chronic bronchitis. Chest 1988; 94: 772-778.
47. Bee D, Wach RA: Hypoxic pulmonary vasoconstriction in chronically hypoxic rats. Respir Physiol 1984; 56: 91-103.
48. Hill NS, Ou LC: The role of pulmonary vascular responses to chronic hypoxia in the development of chronic mountain sickness in rats. Respir Physiol 1984; 58: 171-185.
49. Ou LC, Sardella GL, Hill NS, Tenney SM: Acute and chronic pulmonary pressor responses to hypoxia - the role of blunting acclimatization. Respir Physiol 1986; 64: 81-91.
50. Hampl V, Herget J: Perinatal hypoxia increases hypoxic pulmonary vasoconstriction in adult rats recověřing from chronic exposure to hypoxia. Am Rev Respir Dis 1990; 142: 612-624.
51. Wetzel RC, Zacur HA, Sylvester JT: Effect of puberty and estradiol on hypoxic vasomotor response in isolated sheep lungs. J Appl Physiol 1984; 56: 1199-1203.
52. Cutaia M, Friedrich P, Grimson R, Porcelli RJ: Pregnancy- and gender-related changes in pulmonary vascular reactivity. Exp Lung Res 1987; 13: 343-357.
53. Weir EK, Greer BE, Smith SC, Silvers GW, Droeremueller W, Reeves JT, Grover RF: Bronchoconstriction and pulmonary hypertension during abortion induced by 15-methyl prostaglandin F2alpha. Am J Med 1976; 60: 556-562.
54. Moore LG, Reeves JT: Pregnancy blunts pulmonary vascular reactivity in dogs. Am J Physiol 1980; 239: H297-H301.
55. Fuchs KI, Moore LG, Rounds S: Pulmonary vascular reactivity is blunted in pregnant rats. J Appl Physiol 1982; 53: 703-707.
56. Pipili E, Wilson KA: The influence of the oestrous cycle and of acute 17-beta-oestradiol upon pressor response in the pithed rat to noradrenaline, angiotensin and stimulation of spinal sympathetic outflow. Proc BPS 1979; April
57. Gisclard V, Miller VM, Vanhoutte PM: Effect of 17 beta-estradiol on endothelium-dependent responses in the rabbit. J Pharmacol Exp Ther 1988; 244: 19-22.
58. Chang WC, Nakao J, Orimo H, Murota SI: Stimulation of prostacyclin biosynthetic activity by estradiol in rat aortic smooth muscle cells in culture. Biochim Biophys Acta 1980; 619: 107-118.
59. Lewis AB, Heymann MA, Rudolph AM: Gestational changes in pulmonary vascular responses in fetal lambs in utero. Circ Res 1976; 39: 536-541.
60. Morin FC, Egan EA, Ferguson W, Lundgren CEG: Development of pulmonary vascular response to oxygen. Am J Physiol 1988; 254: H542-H546.
61. Tyler T, Wallis R, Leffler C, Cassin S: The effects of indomethacin on the pulmonary vascular response to hypoxia in the premature and mature newborn goat. Proc Soc Exp Biol Med 1975; 150: 695-698.
62. Owen-Thomas JB, Reeves JT: Hypoxia and pulmonary arterial pressure in the rabbit. J Physiol 1969; 201: 665-672.
63. Fike CD, Hansen TN: Hypoxic vasoconstriction increases with postnatal age in lungs from newborn rabbits. Circ Res 1987; 60: 297-303.
64. Tucker A, Andersen KK, Babyak SD, Wilke WL: Pulmonary hypertension and increased pulmonary vascular reactivity in rats exposed at 10,000 ft since birth. 30th ASPEN Lung Conference 1987
65. Rendas A, Branthwaite M, Lennox S, Reid L: Response of the pulmonary circulation to acute hypoxia in the growing pig. J Appl Physiol 1982; 52: 811-814.
66. Gordon JB, Tod ML, Wetzel RC, McGeady ML, Adkinson NF, Sylvester JT: Age-dependent effects of indomethacin on hypoxic vasoconstriction in neonatal lamb lungs. Pediatr Res 1988; 23: 580-584.
67. Tod M, Sylvester JT: Distribution of pulmonary vascular pressure as a function of perinatal age in lambs. J Appl Physiol 1989; 66: 79-87.
68. Reeves JT, Leathers JE: Circulatory changes following birth of the calf and the effect of hypoxia. Circ Res 1964; 15: 343-354.
69. Tucker A, Greenlees KJ, Gotshall RW: Pulmonary and systemic vascular responses to tolazoline in neonatal and mature calves. Pediatr Pharmacol 1984; 4: 115-128.
70. Raj JU, Hillyard R, Kaapa P, Gropper M, Anderson J: Pulmonary arterial and venous constriction during hypoxia in 3- to 5-wk-old and adult ferrets. J Appl Physiol 1990; 69: 2183-2189.
71. Abman SH, Chatfield BA, Rodman DM, Hall SL, McMurtry IF: Maturational changes in endothelium-derived relaxing factor of ovine pulmonary arteries in vitro. Am J Physiol 1991; 260: L280-L285.
72. Liu SF, Hislop AA, Haworth SG, Barnes PJ: Developmental changes in endothelium-dependent pulmonary vasodilation in pigs. Br J Pharmacol 1992; 106: 324-330.
73. Halbower AC, Tuder RM, Franklin WA, Pollock JS, Förstermann U, Abman SH: Maturation-related changes in endothelial nitric oxide synthase immunolocalization in developing ovine lung. Am J Physiol 1994; 11: L585-L591.
74. Kinsella JP, Ivy DD, Abman SH: Ontogeny of NO activity and response to inhaled NO in the developing ovine pulmonary circulation. Am J Physiol 1994; 36: H1955-H1961.
75. Reid LM: The pulmonary circulation: remodeling in growth and disease. Am Rev Respir Dis 1979; 119: 531-546.
76. Haworth SG: Pulmonary vascular remodeling in neonatal pulmonary hypertension: state of the art. Chest 1988; 93: 133S-138S.
77. Fleisch JH: Age-related changes in the sensitivity of blood vessels to drugs. Pharmacol Ther 1980; 8: 477-487.
78. Tucker A, Greenlees KJ, Wright ML, Migally N: Altered vascular responsiveness in isolated perfused lungs from aging rats. Exp Lung Res 1982; 3: 29-35.
79. Custer JR, Hales CA: Chemical sympathectomy decreases alveolar hypoxic vasoconstriction in lambs but not in sheep. J Appl Physiol 1986; 60: 32-37.
80. Grover RF, Johnson RL, McCullough RG, McCullough RE, Hofmeister SE, Campbell WB, Reynolds RC: Pulmonary hypertension and pulmonary vascular reactivity in beagles at high altitude. J Appl Physiol 1988; 65: 2632-2640.
81. Cardus J, Burgos F, Diaz O, Roca J, Barbera JA, Marrades RM, Rodriguez-Roisin R, Wagner PD: Increase in pulmonary ventilation-perfusion inequality with age in healthy individuals. Am J Respir Crit Care Med 1997; 156: 648-653.
82. Bressack MA, Bland RD: Alveolar hypoxia increases lung fluid filtration in unanesthetized newborn lambs. Circ Res 1980; 46: 111-116.
83. Hazinski TA, Kennedy KA: Alveolar hypoxia increases small pulmonary wedge pressure in awake young lambs. Pediatr Res 1987; 22: 679-682.
84. Raj JU, Chen P: Micropuncture measurement of microvascular pressures in isolated lamb lungs during hypoxia. Circ Res 1986; 59: 398-404.
85. Raj JU, Chen P: Effect of edema on segmental vascular resistance in isolated lamb lungs determined by micropuncture. Circ Res 1987; 61: 236-243.
86. Fike CD, Lai-Fook SJ, Bland RD: Microvascular pressures during hypoxia in isolated lungs of newborn rabbits. J Appl Physiol 1988; 65: 283-287.
87. Hyman AL, Kadowitz PJ: Effects of alveolar and perfusion hypoxia and hypercapnia on pulmonary vascular resistance in the lamb. Am J Physiol 1975; 228: 397-403.
88. Reeves JT, Wagner WW, McMurtry IF, Grover RF: Physiological effects of high altitude on the pulmonary circulation. Int Rev Physiol 1979; 20: 289-309.
89. Berger MG, Vandier C, Bonnet P, Jackson WF, Rusch NJ: Intracellular
acidosis differentially regulates KV channels in coronary and pulmonary vascular muscle. Am J Physiol
1998; 275: H1351-H1359.
| Předchozí část... |
|