Pro potvrzení funkce specifického mediátoru musí látka s plicním vazoaktivním účinkem splňovat kritéria odvozená z tzv. Kochových postulátů. Při hypoxii se musí uvolňovat v blízkosti plicních arteriol. Její působení musí být při reoxygenaci reverzibilní a musí mu zabránit specifičtí antagonisté syntézy i působení dané látky. Studium mediátorů HPV má navíc řadu problémů. Uvažované látky mají často povahu autakoidů. In vivo tedy působí ve velmi nízkých koncentracích v omezeném prostoru. Taková situace je experimentálně prakticky nedostupná. Údaje jsou často získány po infúzi velkých dávek do plicního oběhu, což může mít jiné důsledky než místní uvolnění malého množství stejné látky. K výzkumu se používají různé farmakologické inhibitory působení studovaných látek. Jejich specificita je však často malá nebo nedostatečně známá. HPV je ovlivňována velikostí bazálního tonu plicních cév a rozlišení, zda pozorovaný efekt je důsledkem interakce inhibitoru s mechanismem HPV či jen nespecifickým projevem farmakologického ovlivnění bazálního tonu hladkého svalu, bývá obtížné.
Laktát navrhl jako mediátor HPV Liljestrand [1]. Vycházel z nálezu selektivního oslabení HPV inhibitorem glykolýzy jodoacetátem [2, 1]. Stanbrook a McMurtry [3] však ukázali, že k inhibici HPV dochází pouze tehdy, je-li jodoacetát injikován jako bolus přímo do plícnice. Účinná koncentrace je pak po krátkou dobu podstatně větší, než je-li stejná dávka rozpuštěna v perfuzátu předem. Otupení HPV je tedy asi důsledkem působení jodoacetátu na sulfhudrylové skupiny. K tomu nedochází při předchozím rozpuštění v perfuzátu a pak jodoacetát HPV naopak potencuje. Zesílení HPV bylo pozorováno i při inhibici glykolýzy hypoglykémií a 2-deoxyglukózou [3]. Proti laktátu jako mediátoru HPV hovoří i fakt, že produkce laktátu zůstává zvýšená ještě hodinu po ukončení akutní hypoxie [4]. HPV ustupuje po několika desítkách sekund.
Noradrenalin působí za normálně nízkého tonu plicních cév konstrikci prostředníctvím alfa1-receptorů [5, 6]. Vzhledem k tomu, že noradrenalin je jen slabý beta-agonista, je poněkud překvapivé, že při vyšším tonu plicních cév může převládnout beta2-dilatační odpověď na noradrenalin [7]. Jinou zvlástností je možnost zvrátit vazokonstrikční odpověď zprostředkovanou alfa-receptory na vazodilatační zvýšením výchozího tonu plicních cév [8].
Mediátorovou funkci noradrenalinu naznačilo zmenšení HPV působením alfa-antagonistů [9, 10, 11]. V množství jiných prací však blokáda alfa-receptorů hypoxickou plicní vazokonstrikci neovlivnila [12, 13, 14, 15, 16, 17, 18, 19, 20]. Naproti tomu aktivace beta-receptorů hypoxickou plicní vazokonstrikci inhibuje. Studie s beta-agonisty souhlasně ukazují oslabení HPV [21, 22, 23, 24, 25, 157] zatímco beta-blokáda hypoxickou plicní vazokonstrikci posiluje [13, 26] nebo je bez účinku [27, 20]. Bylo dokonce pozorováno oslabení HPV exogenním noradrenalinem, kterému zabránila beta-blokáda [6].
Při akutní hypoxii (pokud není extrémní) se nezvyšuje koncentrace noradrenalinu v plazmě [21]. Asi i proto deplece noradrenalinu reserpinem neovlivňuje HPV [12, 28, 16]. Proti mediátorové roli noradrenalinu v HPV hovoří také skutečnost, že noradrenalin působí spíše na větší cévy než hypoxie [29].
Serotonin (5-hydroxytriptamin, 5-HT) přítomný v plicních žírných buňkách [30] a neuroepiteliálních tělískách [31] nebyl experimentálními nálezy potvrzen jako mediátor HPV. Má sice silný plicní vazokonstrikční účinek [32, 33, 155], avšak ne u všech živočišných druhů [34] (např. ne u lidí [35]). Na rozdíl od hypoxie působí silně i na žilní část řečiště [32, 33, 155] a vede ke kontrakci větších cév než hypoxie [29, 155]. Blokáda vazokonstrikčního účinku serotoninu dietylamidem kyseliny lysergové či ketanserinem (přednostní inhibitor 5-HT2 receptorů) neovlivnila HPV [10, 36]. HPV nebyla inhibována ani deplecí serotoninu [37]. Plicní vazokonstrikční odpověď na serotonin je potencována alkalózou [38], která tlumí HPV. Ani serotonin tedy není mediátorem HPV.
Histamin byl svého času vážným kandidátem na funkci mediátoru HPV. Bylo pro ní nalezeno několik argumentů. Hypoxie vede ke zvýšení množství histaminu v krvi v levé síni [39]. Aktivace H1 receptorů působí plicní vazokonstrikci [40]. Vysoké dávky antihistaminik inhibují HPV [41, 42]. Blokáda histaminázy, která histamin odbourává, hypoxickou plicní vazokonstrikci potencuje [41].
Důkazy proti působení histaminu v mechanismu HPV dnes však vysoce převažují. Role hlavních zdrojů histaminu v plicích, žírných buněk a trombocytů, není pravděpodobná (viz výše). Prostředníctvím H2 receptorů působí histamin plicní vazodilataci [43]. K aktivaci H2 receptorů dochází při nižších dávkách histaminu, než jakých je třeba pro uplatnění vazokonstrikčních receptorů H1 [40]. Vazodilatační odpověď na histamin převládá při vysokém tonu, například při akutní hypoxii [44]. Ve fetálních plicích, kde je HPV silná, je histaminu velmi málo [45] a má vylučně vazodilatační účinek [46]. U skotu působí histamin pouze vazodilataci i v dospělosti [47]. Pokud se uplatňuje vazokonstrikční účinek histaminu, děje se tak především na žilní straně plicního řečiště [48, 49, 50]. Akutní hypoxie naproti tomu působí konstrikci plicních arteriol [51, 52, 49]. Působení histaminu na plicní cévy je potencováno alkalózou [38], která spíše oslabuje HPV [9]. In vitro neuvolňují buňky plicního parenchymu [53] ani proužky plicní tkáně [54] při hypoxii zvýšené množství histaminu. Rovněž akutní hypoxie in vivo nemění obsah histaminu v plicích [55]. Přibývání histaminu v krvi v levé síni při hypoxii je předcházeno podobným přírůstkem v krvi v síni pravé [56]. Jde tedy o histamin systémového původu. Antihistaminika v dávkách postačujících k inhibici účinku exogenního histaminu neblokují HPV [57, 58]. Opačné výsledky byly zřejmě projevem nespecifického účinku příliš vysokých dávek. Blokáda uvolnění histaminu neovlivňuje HPV [59].
Histamin tedy není mediátorem HPV. Podobně jako všechny další látky diskutované v této souvislosti však může na HPV působit nepřímo ovlivněním bazálního tonu.
Angiotensin II působí plicní vazokonstrikci [60], i když slabší než v systémovém řečišti [61]. Z hlediska HPV vyvolal zájem o angiotensin II Berkov [62]. Zjistil, že zatímco izolované plíce perfundované umělým médiem nejsou citlivé k hypoxii, přidání nízké dávky angiotensinu II umožní vyvolání HPV. McMurtry [63] však ukázal, že stejně působí i řada dalších látek s odlišnými mechanismy působení (KCl, vanadát, 4-aminopyridin, noradrenalin). Jejich jediným známým společným účinkem na hladký sval je zvýšení bazálního tonu.
Proti možnosti, že angiotensin II je mediátorem HPV, svědčí i další skutečnosti. Fretky a kočky reagují výraznou plicní vazokonstrikcí na hypoxii, citlivost jejich plicních cév k působení angiotensinu II je však relativně malá [64, 65]. Blokáda angiotensinových receptorů u laboratorních potkanů, psů a ovčích fétů saralasinem není provázena oslabením HPV [66, 67, 68]. Velikost HPV nemění ani kaptopril, který inhibuje proteázu přeměňující dekapeptid angiotensin I na oktapeptid angiotensin II [69]. Aktivita angiotensinkonvertujícího enzymu se při akutní hypoxii nemění [70]. Celková konverze angiotensinu v plicích při akutní hypoxii dokonce klesá [71, 70].
Adenosin má dva předpoklady pro funkci mediátoru. Jeho uvolňování z plicní tkáně se při hypoxii zvyšuje [72] a prostředníctvím A1-receptorů působí zvýšení celkového plicního cévního odporu a kontraktility izolované plícnice [73]. Navíc je poločas adenosinu velmi krátký. Naproti tomu proti mediátorové úloze svědčí několik argumentů. Aktivace A2-receptorů působí plicní vazodilataci [74]. Ty pravděpodobně zprostředkují oslabení HPV v izolovaných plicích adenosinem [72, 75]. Zvýšení plicního cévního odporu při infúzi adenosinu psům [76] je zprostředkováno uvolněním tromboxanu, který se velmi pravděpodobně při HPV neuplatňuje. Neselektivní blokáda adenosinových receptorů nemění velikost HPV [156].
Faktor aktivující trombocyty (platelet-activating factor, acetyl-glyceryl-eter-fosforylcholin) uvolňují v plicích různé typy buněk. Jeho množství v bronchoalveolární laváži je zvýšeno po 4 hodinách hypoxie [77]. Nízké dávky PAF oslabují HPV [78], vysoké nespecificky zvyšují cévní tonus [79], zčásti snad prostředníctvím uvolnění leukotrienů [80]. Informace o vlivu antagonistů PAF na HPV jsou protichůdné. Některé blokátory (např. SRI 63-441) HPV posilují [81], jiné (BN 52021) jsou bez účinku či (WEB 2086) HPV oslabují [82]. Mediátorová úloha PAF v HPV tedy není pravděpodobná, také pro značné prozánětlivé účinky PAF (plicní zánět tlumí HPV [83, 84, 85]).
Endorfíny nejsou v souvislosti s plicní cirkulací diskutovány často. Možnost jejich účasti v mechanismu HPV naznačil nález inhibice HPV antagonistou opioidních receptorů naloxonem [86] a skutečnost, že leu-enkefalin působí plicní vazokonstrikci [87, 88]. Naloxon také prohlubuje hypoxémii při akutním poškození plic tím, že ruší snížení průtoku krve poškozenou oblastí [89]. Chang a Voelkel [90] však zjistili, že za pozorovaný efekt mohou být odpovědné spíše různé přísady komerčních preparátů. V jejich pokusech čistý naloxon, stejně jako různí opioidní agonisté, hypoxickou plicní vazokonstrikci neovlivňoval. Navíc je známo, že u dospělých zvířat nemění hypoxie plazmatickou hladinu beta-endorfínu [86, 91].
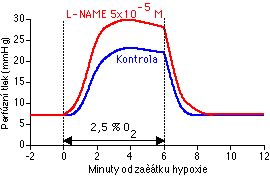
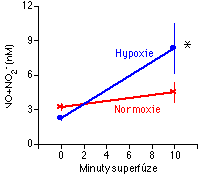
V roce 1980 způsobil Robert Furchgott (dnes laureát Nobelovy ceny) převrat ve fysiologii cév svým objevem endoteliálního relaxačního faktoru (endotelium-derived relaxing factor, EDRF) [92], později identifikovaného jako NO [93, 94]. NO působí plicní vazodilataci aktivací cytoplazmatické formy guanylátcyklázy a následným zvýšením intracelulární hladiny cGMP (některé aspekty mechanismu působení NO jsou podrobněji diskutovány zde). cGMP řadou různých mechanismů snižuje [Ca2+]i [95] a aktivací draslíkových kanálů hyperpolarizuje membránu [96, 97]. Endogenní NO je syntetizován z L-argininu a molekulárního kyslíku [98, 99], takže je možné si představit, že nedostatek kyslíku omezí syntézu tohoto vazodilatancia a tím způsobí vazokonstrikci. Proti této možnosti svědčí celá řada experimentálních nálezů včetně toho, že koncentrace kyslíku začíná limitovat syntézu NO in vitro až při velmi nízkých hodnotách [100], jejichž přítomnost v plicích in vivo není pravděpodobná. Intenzivní výzkum posledních několika let presvědčivě ukázal, že HPV naopak stimuluje endogenní syntézu NO (Obr. 6-6), která působí jako ochranný mechanismus proti přílišnému zvýšení intravaskulárního tlaku (úloha NO při HPV je podrobněji diskutována zde). Tlumení HPV endogenním NO je patrně také příčinou klesající síly HPV s poklesem hematokritu (a tedy s poklesem koncentrace hemoglobinu, který odstraňuje NO) [156].
Atriový natriuretický peptid, složený z 21-32 (u člověka 28) aminokyselinových zbytků, se tvoří v kardiocytech srdce (především pravé komory) a velkých plicních žil [101, 102]. Malé množství atriového natriuretického peptidu uvolňují také pneumocyty [103]. Na cévní hladký sval působí podobně jako EDRF/NO, nestimuluje však cytoplazmatickou (rozpustnou), nýbrž membránovou formu guanylátcyklázy. Navíc snižuje koncentraci cAMP a stimuluje obrat fosfatidylinositolu [104, 105].
Plicní arteriální řečiště je na vazodilatační působení atriového natriuretického faktoru vysoce citlivé [106]. Silnější akutní hypoxie zvyšuje plazmatickou koncentraci atriového natriuretického peptidu u lidí [107, 108], laboratorních potkanů [109], prasat [110], jehňat [111] a psů [112]. Koncentrace peptidu se při hypoxii zvyšuje stejně u jedinců s rozdílnou silou HPV [112]. Exogenní atriový natriuretický peptid v dávce, která odpovídá jeho koncentraci při hypoxii, oslabuje HPV v izolovaných plicích laboratorního potkana i u intaktních potkanů a prasat [110, 109]. Atriový natriuretický peptid tedy pravděpodobně má významnou fyziologickou úlohu v regulaci plicního cévního řečiště při hypoxii i při chronických plicních nemocech. Zcela jistě však není mediátorem HPV.
Endoteliny (ET) jsou malá rodina peptidů z ~23 aminokyselinových zbytků tvořených v endotelu [113, 114], a to i plicním [115]. Nejběžnějším je ET-1. Aktivace ET receptorů typu A (ETA), který se v plicích nachází především v cévním hladkém svalu [116, 117], působí plicní vazokonstrikci [118, 119, 120, 121]. Vzrůst [Ca2+]i potřebný pro vazokonstrikci je dosažen aktivací Ca2+ kanálů sarkoplasmatického retikula i plasmalemmy a aktivací chloridového kanálu plasmalemmy, která působí depolarizaci [120]. Aktivace ETB receptorů, které jsou hlavně na endotelu [116, 120], působí plicní vazodilataci [120, 122], pravděpodobně zprostředkovanou uvolněním NO [120, 122]. Receptory ETA mají větší afinitu k ET-1 než ETB [120].
ET-1 je v současnosti jediným vážným kandidátem na roli mediátoru HPV. Akutní hypoxie zvyšuje sekreci ET-1 v plicích [123]. Podle některých autorů inhibují selektivní antagonisté ETA receptorů BQ-123 [124, 125] a A-127722 [126] HPV u dospělých potkanů [124, 126] a novorozených jehňat [125]. Sméšené blokátory ETA a ETB receptorů bosentan a SE 209670 mají podobný účinek u potkanů [127] a psů [128], i když zde nelze vyloučit nespecifický vliv snížení výchozího normoxického tonu.
V jiných studiích však BQ-123 velikost HPV u potkanů a jehňat neovlivnil [129, 121]. Proti mediátorové úloze ET-1 v HPV svědčí také zjištění, že exogenní ET-1 dilatuje hypoxií kontrahované plicní cévní řečiště prasete [130, 127]. Navíc existuje diskrepance v lokalizaci HPV a vazokonstrikční odpovědi na ET-1 v normoxických plicích: v případě HPV jde hlavně o prekapilární plicní cévy, zatímco v případě ET-1 spíše o žilní část plicního řečiště [121]. U zdravých lidí vyžaduje měřitelné zvýšení plazmatické koncentrace ET-1 v arteriální krvi nejméně čtyřicetiminutové působení hypoxie [131], zatímco HPV nastává během několika sekund až minut [132, 131]. S velmi rychlým nástupem i ústupem HPV kontrastuje pozvolny nástup vazokonstrikce po podání exogenního ET-1, jakož i mimořádně pomalý ústup vazokonstrikce po vymytí ET-1 [133, 115, 120].
Přestože tedy výzkum úlohy ET-1 při HPV není zdaleka uzavřen, zdá se, že ET-1 má v akutní HPV podpůrnou, nikoliv však primární úlohu. Naproti tomu se zdá čím dál pravděpodobnějsí, že ET-1 má důležitou roli při chronické plicní hypertenzi, včetně hypoxické [134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152].
| Předchozí část... |
|
1. Liljstrand G: Chemical control of the distribution of the pulmonary blood flow. Acta Physiol Scand 1958; 44: 216-240.
2. Duke HN, Killick EM: Pulmonary vasomotor responses of isolated perfused cat lungs to anoxia. J Physiol 1952; 117: 303-316.
3. Stanbrook HS, McMurtry IF: Inhibition of glycolysis potentiates hypoxic vasoconstriction in rat lungs. J Appl Physiol 1983; 55: 1467-1473.
4. Longmore WJ, Mourning JT: Lactate production in isolated perfused rat lung. Am J Physiol 1976; 231: 351-354.
5. Howard P, Barer GR, Thompson B, Warren PM, Abbott CJ, Mungall IPF: Factors causing and reversing vasoconstriction in unventilated lung. Respir Physiol 1975; 24: 325-345.
6. Cutaia M, Friedrich P: Hypoxia-induced alterations of norepinephrine vascular reactivity in isolated perfused cat lung. J Appl Physiol 1987; 63: 982-987.
7. Silove ED, Inoue T, Grover RF: Comparison of hypoxia, pH, and sympathomimetic drugs on bovine pulmonary vasculature. J Appl Physiol 1968; 24: 355-365.
8. Hyman AL, Kadowitz PJ: Enhancement of alpha- and beta-adrenoceptor responses by elevations in vascular tone in pulmonary circulation. Am J Physiol 1986; 250: H1109-H1116.
9. Lloyd T: Effect of alveolar hypoxia on pulmonary vascular resistance. J Appl Physiol 1964; 19: 1086-1094.
10. Barer GR: Reactivity of the vessels of collapsed and ventilated lungs to drugs and hypoxia. Circ Res 1966; 18: 366-378.
11. Lagneaux D: Relation between peripheral chemoreceptors stimulation and pulmonary arterial blood pressure in rats. Arch Int Physiol Biochim 1986; 94: 127-134.
12. Goldring RA, Turino GM, Cohen G, Jameson AG, Bass BG, Fishman AP: The catecholamines in the pulmonary arterial pressor response to acute hypoxia. J Clin Invest 1964; 41: 1211-1220.
13. Thilenius OG, Candiolo SM, Beug JL: Effect of adrenergic blockade on hypoxia-induced pulmonary vasoconstriction in awake dogs. Am J Physiol 1967; 213: 990-998.
14. Daly IdB, Michel CC, Ramsay DJ, Waaler BA: Conditions governing the pulmonary vascular response to ventilation hypoxia and hypoxaemia in the dog. J Physiol 1968; 196: 351-379.
15. Duke HN: The effect of adrenergic alpha-blocking agents on the pulmonary vasoconstrictor response to hypoxia in isolated cat lungs. J Physiol 1968; 196: 59P-61P.
16. Silove ED, Grover RF: Effects of alpha adrenergic blockade and tissue catecholamines depletion on pulmonary vascular response to hypoxia. J Clin Invest 1968; 47: 274-285.
17. Duke HN: The pulmonary pressor response to hypoxia in isolated perfused lungs of cats: the influence of mepyramine maleate and semicarbazide. J Physiol 1969; 200: 133P-135P.
18. Malik AB, Kidd BSL: Adrenergic blockade and the pulmonary vascular response to hypoxia. Respir physiol 1973; 19: 96-106.
19. Madden JA, Dawson CA, Harder DR: Hypoxia-induced activation in small isolated pulmonary arteries from the cat. J Appl Physiol 1985; 59: 113-118.
20. Lodato RF, Michael JR, Murray PA: Absence of neural modulation of hypoxic pulmonary vasoconstriction in conscious dogs. J Appl Physiol 1988; 65: 1481-1487.
21. Porcelli RJ, Viau A, Demeny M, Naftchi NE, Bergofsky EH: Relation between hypoxic pulmonary vasoconstriction, its humoral mediators and alpha-beta adrenergic receptors. Chest 1977; 71: 249-251.
22. Isawa T, Teshima T, Hirano T, Ebina A, Shiraishi K, Konno K: Effect of isoproterenol on regional pulmonary perfusion and its blockade by propranolol. Tohoku J Exp Med 1981; 134: 59-69.
23. Conover WB, Benumof JL, Key TC: Ritodrine inhibition of hypoxic pulmonary vasoconstriction. Am J Obstet Gynecol 1983; 146: 652-656.
24. Orchard CH, Leon de RS, Sykes MK: The relationship between hypoxic pulmonary vasoconstriction and arterial oxygen tension in the intact dog. J Physiol 1983; 338: 61-74.
25. Fried R, Reid LM: The effect of isoproterenol on the development and recovery of hypoxic pulmonary hypertension: a structural and hemodynamic study. Am J Pathol 1985; 121: 102-111.
26. Porcelli RJ, Bergofsky EH: Adrenergic receptors in pulmonary vasoconstrictor responses to gaseous and humoral agents. J Appl Physiol 1973; 34: 483-488.
27. Miller JR, Benumof JL, Trousdale FR: Combined effects of sodium nitroprusside and propranolol on hypoxic pulmonary vasoconstriction. Anesthesiology 1982; 57: 267-271.
28. Lloyd TC: Role of nerve pathways in the hypoxic vasoconstriction of the lung. J Appl Physiol 1966; 21: 1351-1355.
29. Hakim TS: Identification of constriction in large versus small vessels using the arterial-venous and the double-occlusion techniques in isolated canine lungs. Respiration 1988; 54: 61-69.
30. Selye H: The Mast Cells Washington, D.C., Butterworth, 1965;
31. Keith IM, Will JA: Hypoxia and the neonatal rabbit lung: neuroendocrine cell numbers, 5-HT fluorescence intensity, and the relationship to arterial thickness. Thorax 1981; 36: 767-773.
32. Aviado DM: Pulmonary venular responses to anoxia, 5-hydroxytriptamine and histamine. Am J Physiol 1960; 198: 1032-1036.
33. Hofman WF, Ehrhart IC: Effects of cyclooxygenase inhibition on pulmonary vascular responses to serotonin. J Appl Physiol 1987; 62: 1192-1200.
34. Weir EK, Will DH, Alexander AF, McMurtry IF, Looga R, Reeves JT, Grover RF: Vascular hypertrophy in cattle susceptible to hypoxic pulmonary hypertension. J Appl Physiol 1979; 46: 517-521.
35. Harris P, Heath D: The Human Pulmonary Circulation (Second edition ed.). Edinburgh, Churchill Livingstone, 1977; 712.
36. Helgesen KG, Bjertnaes L: The effect of ketanserin on hypoxia-induced vasoconstriction in isolated lungs. Int J Microcirc 1986; 5: 65-72.
37. Hauge A, Melmon KL: Role of histamine in hypoxic pulmonary hypertension in the rat. II. Depletion of histamine, serotonin and catecholamines. Circ Res 1968; 22: 385-392.
38. Bronstein EH, Porcelli RJ: Effect of hydrogen ion concentration on in vitro pulmonary vascular reactivity. Exp Lung Res 1988; 14: 837-851.
39. Aviado DM, Samánek M, Folle LE: Cardiopulmonary effects of tobacco and related substances. Arch Environ Health 1966; 12: 705-712.
40. Barer GR, Emery CJ, Mohammed FH, Mungall IPF, Thompson B: H1 and H2 histamine receptors in the pulmonary circulation. J. Physiol. 1976; 259: 41.
41. Hauge A: Role of histamine in hypoxic pulmonary hypertension in the rat. I. Blockade or potentiation of endogenous amines, kinins, and ATP. Circ Res 1968; 22: 371-383.
42. Susmano A, Carleton RA: Prevention of hypoxic pulmonary hypertension by chlorpheniramine. J Appl Physiol 1971; 31: 531-535.
43. Tucker A, Weir EK, Reeves JT, Grover RF: Histamine H1 and H2 receptors in the pulmonary and systemic vasculature of the dog. Am J Physiol 1975; 229: 1008-1013.
44. Barer GR, McCurrie JR: Pulmonary vasomotor responses in the cat: the effects and interrelationship of drugs, hypoxia and hypercapnia. Q J Exp Physiol 1969; 259: 156-172.
45. Newman JH, Souhrada JF, Reeves JT, Arroyave CM, Grover RF: Postnatal changes in response of canine neonatal pulmonary arteries to histamine. Am J Physiol 1979; 237: H76-H82.
46. Daws GS, Mott JC: The vascular tone of the foetal lung. J Physiol 1962; 164: 465-477.
47. Silove ED, Simcha AJ: Histamine-induced vasodilation in the calf: relationship to hypoxia. J Appl Physiol 1973; 38: 830-836.
48. Dawson CA, Forrester TE, Hamilton LH: Effects of hypoxia and histamine infusion on lung blood volume. J Appl Physiol 1975; 38: 811-816.
49. Dawson CA, Linehan JH, Bronikowski TA, Rickaby DA: Pulmonary microvascular hemodynamics: occlusion methods. In: Will JA, Dawson CA, Weir EK, Buckner CK, Eds. The Pulmonary Circulation in Health and Disease. Orlando, Academic Press, 1987; 175-197.
50. Shirai M, Sada K, Ninomiya I: Nonuniform effects of histamine on small pulmonary vessels in cats. J Appl Physiol 1987; 62: 451-458.
51. Nagasaka K, Bhattacharya J, Nanjo S, Gropper MA, Staub NC: Micropuncture measurement of lung microvascular pressure profile during hypoxia in cats. Circ Res 1984; 54: 90-95.
52. Shirai M, Sada K, Ninomiya I: Effects of regional alveolar hypoxia and hypercapnia on small pulmonary vessels in cats. J Appl Physiol 1986; 61: 440-448.
53. Patterson NAM: Influence of hypoxia on histamine and leukotriene release from disperse porcine lung cells. J Appl Physiol 1986; 61: 1790-1795.
54. Peters SP, Lichtenstein LM, Adkinson NF: Mediator release from human lung under conditions of reduced oxygen tension. J Pharmacol Exp Ther 1986; 238: 8-13.
55. Kay JM, Waymire JC, Grover RF: Lung mast cell hyperplasia and pulmonary histamine-forming capacity in hypoxic rats. Am J Physiol 1974; 226: 178-184.
56. Rengo F, Trimarco B, Chiariello M, Ricciardelli B, Volpe M, Violini R, Rasetti G: Histamine and hypoxic pulmonary hypertension: a quantitative study. Cardiovasc Res 1978; 12: 752-757.
57. Hales CA, Kazemi H: Role of histamine in the hypoxic vascular response of the lung. Respir Physiol 1975; 24: 81-88.
58. Goetzman BW, Milstein JM: Pulmonary vascular histamine receptors in newborn and young lambs. J Appl Physiol 1980; 49: 380-385.
59. Dawson CA, Delano FA, Hamilton LH, Stekiel WJ: Histamine releasers and hypoxic vasoconstriction in isolated cat lungs. J Appl Physiol 1974; 37: 670-674.
60. Bergofsky EH: Mechanisms underlying vasomotor regulation of regional pulmonary blood flow in normal and disease states. Am J Med 1974; 57: 378-394.
61. Barer GR: Active control of the pulmonary circulation. In: Cumming G, Bonsignore G, Eds. Pulmonary Circulation in Health and Disease. New York, Plenum Press, 1979; 81-99.
62. Berkov S: Hypoxic pulmonary vasoconstriction in the rat: the necessary role of angiotensin II. Circ Res 1974; 35: 257-261.
63. McMurtry IF: Angiotensin is not required for hypoxic constriction in salt solution-perfused rat lungs. J Appl Physiol 1984; 56: 375-380.
64. Barer GR: A comparison of the circulatory effects of angiotensin, vasopressin, and adrenaline in the anesthetized cat. J Physiol 1961; 156: 49-66.
65. Suggett AJ, Mohammed FH, Barer GR: Angiotensin, hypoxia, verapamil and pulmonary vessels. Clin Exp Pharmacol Physiol 1980; 7: 263-274.
66. Hyman AL, Heyman MA, Levin DL, Rudolph AM: Angiotensin is not the mediator of hypoxia-induced pulmonary vasoconstriction in fetal lambs. Circulation 1975; 52: II-132.
67. McMurtry IF, Davidson AB, Reeves JT, Grover RF: Inhibition of hypoxic pulmonary vasoconstriction by calcium antagonists in isolated rat lungs. Circ Res 1976; 38: 99-104.
68. Hales CA, Rouse ET, Kazemi H: Failure of saralasin acetate, a competitive inhibitor of angiotensin II, to diminish alveolar hypoxic vasoconstriction in the dog. Cardiovasc Res 1977; 11: 541-546.
69. Prewitt RL, Leffler CW: Feline hypoxic pulmonary vasoconstriction is not blocked by the angiotensin I-converting enzyme inhibitor, captopril. Cardiovasc Pharmacol 1981; 3: 293-298.
70. Shepard JM, Joyner WL, Gilmore JP: Hypoxia does not alter angiotensin converting enzyme activity in hamster pulmonary microvessels. Circ Res 1987; 61: 228-235.
71. Rickaby DA, Bongard RD, Tristani MJ, Linehan JH, Dawson CA: Effects of gas composition and pH on kinetics of lung angiotensin-converting enzyme. J Appl Physiol 1987; 62: 1216-1221.
72. Mentzer RM, Rubio R, Berne RM: Release of adenosine by hypoxic canine lung tissue and its possible role in pulmonary circulation. Am J Physiol 1975; 229: 1625-1631.
73. Wiklund NP, Cederqvist B, Matsuda H, Gustafsson LE: Adenosine can excite pulmonary artery. Acta Physiol Scand 1987; 131: 477-478.
74. McCormack DG, Clarke B, Barnes PJ: Characterization of adenosine receptors in human pulmonary arteries. Am J Physiol 1989; 256: H41-H46.
75. McMurtry IF, Hookway BW, Roos SD: Red blood cells but not platelets prolong vascular reactivity of isolated rat lungs. Am J Physiol 1978; 234: H186-H191.
76. Biaggioni I, King LS, Enayat N, Robertson D, Newman JH: Adenosine produces pulmonary vasoconstriction in sheep. Circ Res 1989; 65: 1516-1525.
77. Prevost MC, Cariven C, Simon MF: Platelet activating factor (PAF-acether) is released into rat pulmonary alveolar fluid as a consequence of hypoxia. Biochem Biophys Res Commun 1984; 119: 58.
78. McMurtry IF, Morris KG: Platelet-activating factor causes pulmonary vasodilation in the rat. Am Rev Respir Dis 1986; 134: 757-762.
79. Lichey J, Friedrich T, Franke J, Nigam S, Priesnitz M, Oeff K: Pressure effects and uptake of platelet-activating factor in isolated rat lung. J Appl Physiol 1984; 57: 1039-1044.
80. Davidson D, Sing M, Wallace GF: Role of leukotriene C4 in pulmonary hypertension: platelet-activating factor vs. hypoxia. J Appl Physiol 1990; 68: 1628-1633.
81. Haynes J, Chang SW, Morris KG, Voelkel NF: Platelet-activating factor antagonists increase vascular reactivity in perfused rat lungs. J Appl Physiol 1988; 65: 1921-1928.
82. McCormack DG, Barnes PJ, Evans TW: Evidence against a role for platelet-activating factor in hypoxic pulmonary vasoconstriction in the rat. Clin Sci 1989; 77: 439-443.
83. Light RB, Mink SN, Wood LDH: Pathophysiology of gas exchange and pulmonary perfusion in pneumococcal lobar pneumonia in dogs. J Appl Physiol 1981; 50: 524-530.
84. Light RB: Intrapulmonary oxygen consumption in experimantal pneumococcal pneumonia. J Appl Physiol 1988; 64: 2490-2495.
85. Hampl V, Herget J: Acute pneumonia reversibly inhibits hypoxic vasoconstriction in isolated rat lungs. Physiol Res 1992; 41: 147-150.
86. Bar-Or D, Good JT, Marx JA: Naloxone - effects on hypoxic pulmonary vasoconstriction. Ann Emerg Med 1984; 13: 495-498.
87. Gillespie MN, Bowdy BD, Reinsel CN, Iwamoto ET, Crooks PA: Leu-enkephalin provokes naloxone-insensitive pulmonary vasoconstriction. Life Sci 1984; 34: 1177-1183.
88. Gillespie MN, Reinsel CN, Bowdy BD: Pulmonary vasoactivity of lung endocrine cell-related peptides. Peptides 1984; 5: 21-24.
89. Scardella AT, Neubauer JA, Edelman NH, Santiago TV: Modulation by endogenous opioids of pulmonary vasoconstrictor response to acute lung injury. J Appl Physiol 1988; 64: 1823-1828.
90. Chang SW, Voelkel NF: Actions of opiate agonists, naloxone, and paraben preservatives in the rat lung circulation. Proc Soc Exp Biol Med 1986; 181: 404-410.
91. Freedman A, Scardella AT, Edelman NH, Santiago TV: Hypoxia does not increase CSF or plasma beta-endorphin activity. J Appl Physiol 1988; 64: 966-971.
92. Furchgott R, Zawadzki J: The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature 1980; 288: 373-376.
93. Palmer RMJ, Ferrige AG, Moncada S: Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature 1987; 327: 524-526.
94. Radomski MW, Palmer RMJ, Moncada S: Comparative pharmacology of endothelium-derived relaxing factor, nitric oxide and prostacycin in platelets. Br J Pharmacol 1987; 92: 181-187.
95. Hobbs AJ, Ignarro LJ: The nitric oxide-cyclic GMP signal transduction system. In: Zapol WM, Bloch KD, Eds. Nitric Oxide and the Lung. New York, Marcel Dekker, 1997; 1-57. (Lenfant C, ed. Lung Biology in Health and Disease;
96. Archer SL, Huang JM-C, Hampl V, Nelson DP, Shultz PJ, Weir EK: Nitric oxide and cGMP cause vasorelaxation by activation of a charybdotoxin-sensitive K channel by cGMP-dependent protein kinase. Proc Natl Acad Sci USA 1994; 91: 7583-7587. (abstrakt)
97. Archer SL, Huang JMC, Reeve HL, Hampl V, Tolarová S, Michelakis E, Weir EK: Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and hypoxia. Circ Res 1996; 78: 431-442. (abstrakt)
98. Palmer MJ, Moncada S: A novel citrulline-forming enzyme implicated in the formation of nitric oxide by vascular endothelial cells. Biochem Biophys Res Commun 1989; 158: 348-352.
99. Leone AM, Palmer RM, Knowles RG, Francis PL, Ashton DS, Moncada S: Constitutive and inducible nitric oxide synthases incorporate molecular oxygen into both nitric oxide and citrulline. J Biol Chem 1991; 266: 23790-23795.
100. Rengasamy A, Johns RA: Determination of Km for oxygen of nitric oxide synthase isoforms. J Pharmacol Exp Ther 1996; 276: 30-33.
101. Springall DR, Bhatnagar M, Wharton J, Hamid Q, Gulbenkian S, Hedges M, Meleagros L, Bloom SR, Polak JM: Expression of the atrial natriuretic peptide gene in the cardiac muscle of rat extrapulmonary and intrapulmonary veins. Thorax 1988; 43: 44-52.
102. Toshimori H, Nakazato M, Toshimori K, Asai J, Matsukara S, Okura C, Matsuo H: Distribution of atrial natriuretic polypeptide (ANP)-containing cells in the rat heart and pulmonary vein: immunohistochemical study and radioimmunoassay. Cell Tissue Res 1988; 251: 541-546.
103. Matsubara H, Mori Y, Umeda Y, Oikawa S, Nakazato H, Inada M: Atrial natriuretic peptide gene expression and its secretion by pneumocytes derived from neonatal rat lungs. Biochem Biophys Res Commun 1988; 156: 619-627.
104. Murad F, Leitman DC, Bennett BM, Molina C, A. WS: Regulation of guanylate cyclase by atrial natriuretic factor and the role of cyclic GMP in vasodilation. Am J Med Sci 1987; 294: 139-143.
105. Resink TJ, Scott-Burden T, Baur U, Jones CR, Buhler FR: Atrial natriuretic peptide induces breakdown of phosphatidylinositol phosphates in cultured vascular smooth-muscle cells. Eur J Biochem 1988; 172: 499-505.
106. Jansen TLTA, Morice AH, Brown MJ: A comparision of the vasodilator responses to atrial peptides in the pulmonary and renal arteries of the pig in vitro. Br J Pharmacol 1987; 91: 687-691.
107. du Souich P, Saunier C, Hartemann D, Sautegeau A, Ong H, Larose P, Babini R: Effect of moderate hypoxemia on atrial netriuretic factor and arginine vasopressine in normal man. Biochem Biophys Res Commun 1987; 148: 906-912.
108. Kawashima A, Kubo K, Hirai K, Yoshikawa S, Matsuzawa Y, Kobayashi t: Plasma levels of atrial natriuretic peptide under acute hypoxia in normal subjects. Respir Physiol 1989; 76: 79-92.
109. Hill NS, Ou LC: The possible role of atrial natriuretic factor in modulating the pulmonary hypertensive response to hypoxia. Chest 1988; 93: 95S-96S.
110. Adnot S, Chabrier PE, Brun-Buisson C, Viossat I, Braquet P: Atrial natriuretic factor attenuates the pulmonary pressor response to hypoxia. J Appl Physiol 1988; 65: 1975-1983.
111. Baertschi AJ, Teague WG: Alveolar hypoxia is a powerful stimulus for ANF release in conscious lambs. Am J Physiol 1989; 256: H990-H998.
112. Vachiery J-L, Lejeune P, Hallemans R, Brimioulle S, Debieve MF, Abramow M, Naeije R: Atrial natriuretic peptides in canine hypoxic pulmonary vasoconstriction. Cardiovasc Res 1990; 24: 352-357.
113. Yanagisawa M, Inoue A, Ishikawa T, Kasuya Y, Kimura S, Kumagaye SI, Nakajima K, Watanabe TX, Sakakibara S: Primary structure, synthesis, and biological activity of rat endothelin, an endothelium-derived vasoconstrictor peptide. Proc Natl Acad Sci USA 1988; 85: 6964-6967.
114. Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T: A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988; 332: 411-415.
115. Barnes PJ: Endothelins and pulmonary diseases. J Appl Physiol 1994; 77: 1051-1059.
116. Filep JG: Endothelin peptides: biological actions and pathophysiological significance in the lung. Life Sci 1992; 52: 119-133.
117. Russell FD, Davenport AP: Characterization of endothelin receptors in the human pulmonary vasculature using bosentan, SB209670, and 97-139. J Cardiovasc Pharmacol 1995; 26: S346-S347.
118. Horgan MJ, Pinheiro JMB, Malik AB: Mechanism of endothelin-1-induced pulmonary vasoconstriction. Circ Res 1991; 69: 157-164.
119. Mann J, Farrukh IS, Michael JR: Mechanisms by which endothelin 1 induces pulmonary vasoconstriction in the rabbitt. J Appl Physiol 1991; 71: 410-416.
120. Pollock DM, Keith TL, Highsmith RF: Endothelin receptors and calcium signaling. FASEB J 1995; 9: 1196-1204.
121. Takeoka M, Ishizaki T, Sakai A, Chang SW, Shigemori K, Higashi T, Ueda G: Effect of BQ123 on vasoconstriction as a result of either hypoxia or endothelin-1 in perfused rat lungs. Acta Physiol Scand 1995; 155: 53-60.
122. Wong J, Vanderford PA, Winters J, Soifer SJ, Fineman JR: EndothelinB receptor agonists produce pulonary vasodilation in intact newborn lambs with pulmonary hypertension. J Cardiovasc Pharmacol 1995; 25: 207-215.
123. Helset E, Kjaeve J, Bjertnaes L, Lundberg JM: Acute alveolar hypoxia increases endothelin-1 release but decreases release of calcitonin gene-related peptide in isolated perfused rat lungs. Scand J Clin Lab Invest 1995; 55: 369-376.
124. Oparil S, Chen SJ, Meng QC, Elton TS, Yano M, Chen YF: Endothelin-A receptor antagonist prevents acute hypoxia-induced pulmonary hypertension in the rat. Am J Physiol 1995; 12: L95-L100.
125. Wang Y, Coe Y, Toyoda O, Coceani F: Involvement of endothelin-1 in hypoxic pulmonary vasoconstriction in the lamb. J Physiol 1995; 482: 421-434.
126. Chen SJ, Chen YF, Opgenorth TJ, Wessale JL, Meng QC, Durand J, DiCarlo VS, Oparil S: The orally active nonpeptide endothelin A-receptor antagonist A-127722 prevents and reverses hypoxia-induced pulmonary hypertension and pulmonary vascular remodeling in Sprague-Dawley rats. J Cardiovasc Pharmacol 1997; 29: 713-725.
127. Holm P, Liska J, Clozel M, Franco-Cereceda A: The endothelin antagonist bosentan: hemodynamic effects during normoxia and hypoxic pulmonary hypertension in pigs. J Thorac Cardiovasc Surg 1996; 112: 890-897.
128. Willette RN, Ohlstein EH, Mitchell MP, Sauermelch CF, Beck GR, Luttmann MA, Hay DWP: Nonpeptide endothelin receptor antagonists. 8. Attenuation of acute hypoxia-induced pulmonary hypertension in the dog. J Pharmacol Exp Ther 1997; 280: 695-701.
129. Wong J, Vanderford PA, Winters JW, Chang R, Soifer SJ, Fineman JR: Endothelin-1 does not mediate acute hypoxic pulmonary vasoconstriction in the intact newborn lamb. J Cardiovasc Pharmacol 1993; 22: S262-S266.
130. Liska J, Holm P, Owall A, Francocereceda A: Endothelin infusion reduces hypoxic pulmonary hypertension in pigs in vivo. Acta Physiol Scand 1995; 154: 489-498.
131. Takeda S, Nakanishi K, Inoue T, Ogawa R: Delayed elevation of plasma endothelin-1 during unilateral alveolar hypoxia without systemic hypoxemia in humans. Acta Anaesthesiol Scand 1997; 41: 274-280.
132. Jensen KS, Micco AJ, Czartolomna J, Latham L, Voelkel NF: Rapid onset of hypoxic vasoconstriction in isolated lungs. J Appl Physiol 1992; 72: 2018-2023.
133. Mathew R, Altura BM: Physiology and pathophysiology of pulmonary circulation. Microcirc Endoth Lymphatics 1990; 6: 211-252.
134. Stelzner TJ, O'Brien RF, Yanagisawa M, Sakurai T, Sato K, Webb S, Zamora M, McMurtry IF, Fisher JH: Increased lung endothelin-1 production in rats with idiopathic pulmonary hypertension. Am J Physiol 1992; 262: L614-L620.
135. Allen SW, Chatfield BA, Koppenhafer SA, Schaffer MS, Wolfe RR, Abman SH: Circulating immunoreactive endothelin-1 in children with pulmonary hypertension. Association with acute hypoxic pulmonary vasoreactivity. Am Rev Respir Dis 1993; 148: 519-522.
136. Giaid A, Yanagisawa M, Langleben D, Michel RP, Levy R, Shennib M, Kimura S, Masaki T, Duguid W: Expression of endothelin in the lungs of patients with pulmonary hypertension. N Engl J Med 1993; 328: 1732-1739.
137. Rosenberg AA, Kennaugh J, Koppenhafer SL, Loomis M, Chatfield BA, Abman SH: Elevated immunoreactive endothelin-1 levels in newborn infants with persistent pulmonary hypertension. J Pediatr 1993; 123: 109-114.
138. Donahue DM, Lee M-E, Suen H-C, Quertermous T, Wain JC: Pulmonary hypoxia increases endothelin-1 gene expression in sheep. J Surg Res 1994; 57: 280-283.
139. Li H, Chen S-J, Chen Y-F, Meng QC, Durand J, Oparil S, Elton TS: Enhanced endothelin-1 and endothelin receptor gene expression in chronic hypoxia. J Appl Physiol 1994; 77: 1451-1459.
140. Li H, Elton TS, Chen YF, Oparil S: Increased endothelin receptor gene expression in hypoxic rat lung. Am J Physiol 1994; 266: L553-L560.
141. DiCarlo VS, Chen S-J, Meng QC, Durand J, Yano M, Chen Y-F, Oparil S: ETA-receptor antagonist prevents and reverses chronic hypoxia-induced pulmonary hypertension in rat. Am J Physiol 1995; 269: L690-L697.
142. Eddahibi S, Raffestin B, Clozel M, Levame M, Adnot S: Protection from pulmonary hypertension with an orally active endothelin receptor antagonist in hypoxic rats. Am J Physiol 1995; 268: H828-H835.
143. Ferri C, Bellini C, De Angelis C, De Siati L, Perrone A, Properzi G, Santucci A: Circulating endothelin-1 concentrations in patients with chronic hypoxia. J Clin Pathol 1995; 48: 519-524.
144. Goerre S, Wenk M, Bärtsch P, Lüscher TF, Niroomand F, Hohenhaus E, Oelz O, Reinhart WH: Endothelin-1 in pulmonary hypertension associated with high-altitude exposure. Circulation 1995; 91: 359-364.
145. Kirshbom PM, Tsui SSL, DiBernardo LR, Meliones JN, Schwinn DA, Ungerleider RM, Gaynor JW: Blockade of endothelin-converting enzyme reduces pulmonary hypertension after cardiopulmonary bypass and circulatory arrest. Surgery 1995; 118: 440-445.
146. Mansoor AM, Honda M, Saida K, Ishinaga Y, Kuramochi T, Maeda A, Takabatake T, Mitsui Y: Endothelin induced collagen remodeling in experimental pulmonary hypertension. Biochem Biophys Res Commun 1995; 215: 981-986.
147. Morelli S, Ferri C, Polettini E, Bellini C, Gualdi GF, Pittoni V, Valesini G, Santucci A: Plasma endothelin-1 levels, pulmonary hypertension, and lung fibrosis in patients with systemic sclerosis. Am J Med 1995; 99: 255-260.
148. Okada M, Yamashita C, Okada M, Okada K: Role of endothelin-1 in beagles with dehydromonocrotaline-induced pulmonary hypertension. Circulation 1995; 92: 114-119.
149. Hess P, Clozel M, Clozel J: Telemetry monitoring of pulmonary arterial pressure in freely moving rats. J Appl Physiol 1996; 81: 1027-1032.
150. Aversa CR, Oparil S, Caro J, Li H, Sun SD, Chen YF, Swerdel MR, Monticello TM, Durham SK: Hypoxia stimulates human preproendothelin-1 promoter activity in transgenic mice. Am J Physiol 1997; 273: L848-L855.
151. Cacoub P, Dorent R, Nataf P, Carayon A, Riquet M, Noe E, Piette JC, Godeau P, Gandjbakhch I: Endothelin-1 in the lungs of patients with pulmonary hypertension. Cardiovasc Res 1997; 33: 196-200.
152. Noguchi Y, Hislop AA, Haworth SG: Influence of hypoxia on endothelin-1 binding sites in neonatal porcine pulmonary vasculature. Am J Physiol 1997; 41: H669-H678.
153. Isaacson TC, Hampl V, Weir EK, Nelson DP, Archer SL: Increased endothelium-derived nitric oxide in hypertensive pulmonary circulation of chronically hypoxic rats. J Appl Physiol 1994; 76: 933-940. (abstrakt)
154. Hampl V, Cornfield DN, Cowan NJ, Archer SL: Hypoxia potentiates nitric oxide synthesis and transiently increases cytosolic calcium levels in pulmonary artery endothelial cells. Eur Respir J 1995; 8: 515-522. (abstrakt)
155. Barman SA: Pulmonary vasoreactivity to serotonin during hypoxia is modulated by ATP-sensitive potassium channels. J Appl Physiol 1997; 83: 569-574.
156. Deem S, Swenson ER, Alberts MK, Hedges RG, Bishop MJ: Red-blood-cell augmentation of hypoxic pulmonary vasoconstriction: hematocrit dependence and the importance of nitric oxide. Am J Respir Crit Care Med 1998; 157: 1181-1186.
157. Dumas M, Dumas JP, Bardou M, Rochette L, Advenier C, Giudicelli
JF: Influence of beta-adrenoceptor agonists on the pulmonary circulation:
effects of a beta3-adrenoceptor antagonist, SR 59230A. Eur J Pharmacol 1998; 348:
223-228.
| Předchozí část... |
|